Không có kết quả về nội dung phù hợp với từ khóa tìm kiếm của bạn.
Nội dung
Bạn đã đăng xuất thành công.
Chưa đăng ký tài khoản?
Quy định đối với Thiết bị Y tế
Quy định về Thiết bị Y tế Châu Âu (MDR) với nhiều quy tắc mới là một thách thức đối với tất cả những ai liên quan. B. Braun đang tích cực chuẩn bị và muốn áp dụng các yêu cầu mới càng sớm càng tốt. Trên website này, chúng tôi đã biên soạn một số thông tin về MDR cho bạn.
Quy định mới về Thiết bị Y tế Châu Âu (MDR) có hiệu lực vào tháng 5 năm 2017. Quy định mới thay thế Chỉ thị về Thiết bị Y tế (MDD) hiện có và Chỉ thị về Thiết bị Y tế Cấy ghép chủ động (AIMDD).
Khoảng 500.000 thiết bị y tế ở châu Âu sẽ được chứng nhận lại theo quy định mới toàn diện hơn để được đóng dấu CE. Theo ước tính hiện tại, chỉ khoảng 65 % thiết bị y tế sẽ được chứng nhận theo quy định mới. Một số cơ quan thông báo vẫn đang ở giai đoạn chỉ định và chưa rõ bao nhiêu cơ quan thông báo sẽ có thể hoàn thành quy trình (danh sách trên trang web của Ủy ban Châu Âu). Do những yêu cầu tăng lên đối với các cơ quan và chủ sở hữu thiết bị y tế được thông báo, việc điều chỉnh danh mục sản phẩm là không thể tránh khỏi.
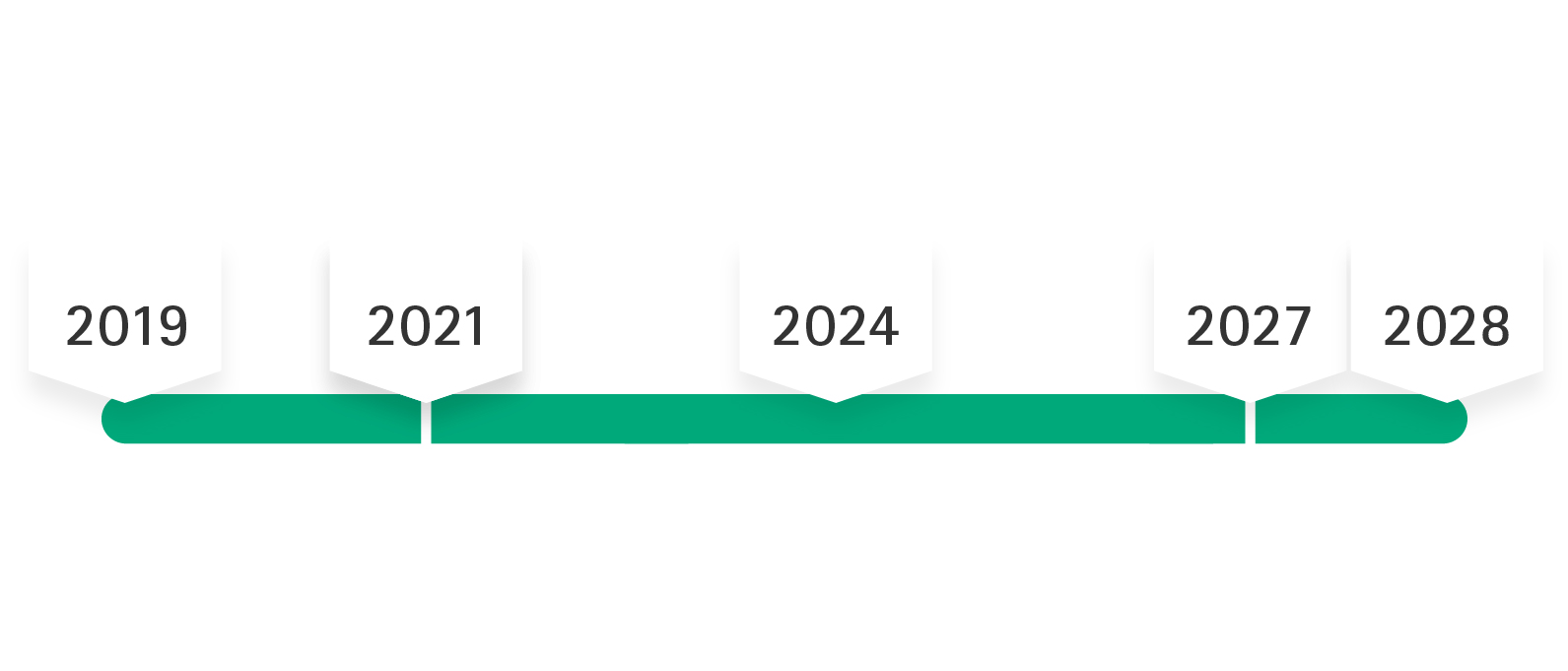
"Thời gian ân hạn" của chứng nhận MDD Không thay đổi thiết kế đối với các sản phẩm được chứng nhận MDD
/
Các sản phẩm phải có chứng nhận MDR (miễn trừ đối với sản phẩm có chứng nhận MDD đã sản xuất, đang bán cho hết)
/
Giấy chứng nhận MDD vẫn còn hợp lệ (thời gian tùy phân loại rủi ro của sản phẩm)
/
Các phạm vi đăng ký bị ảnh hưởng bao gồm:
Để có thể đảm bảo cung ứng liên tục công nghệ y tế an toàn và tiên tiến, tất cả các chủ sở hữu thiết bị y tế phải đối mặt với nhiệm vụ đầy thách thức là vượt qua các yêu cầu tăng lên cần phải có để được chứng nhận CE. Các tổ chức được chỉ định phải thiết lập nền tảng và xây dựng đủ năng lực để thực hiện quy trình đánh giá sự phù hợp.
Từ trước đó, B. Braun đã bắt đầu chuẩn bị rộng rãi cho việc chứng nhận các thiết bị y tế của riêng mình theo MDR. Đương nhiên, điều này áp dụng cho tất cả các sản phẩm mà B. Braun tự sản xuất hoặc mua dưới dạng hàng hóa thương mại để hoàn thiện danh mục đầu tư của mình. Liên quan đến tiến độ của các biện pháp được thực hiện, B. Braun tin tưởng rằng, cho đến tháng 5 năm 2024, hãng sẽ có thể tuân thủ các yêu cầu của MDR .
Việc sửa đổi Chỉ thị về Thiết bị Y tế 93/42 EEC (MDD), được công bố vào năm 1993 và vẫn áp dụng ngày nay, đã trở nên cần thiết ở Châu Âu. Với quy định mới, các cơ quan chức năng của EU muốn cải thiện chất lượng thiết bị y tế và tăng cường an toàn, hài hòa các quy trình thông qua EU và tăng cường an toàn cho người bệnh. Các khía cạnh bổ sung bao gồm cải thiện tính minh bạch và khả năng truy xuất nguồn gốc liên quan đến các công nghệ mới cho phép nhận dạng rõ ràng tất cả các sản phẩm trong suốt vòng đời của chúng.
MDR xác định các yêu cầu mà chủ sở hữu thiết bị y tế phải đáp ứng để có thể bán thiết bị y tế ở Châu Âu. Cả yêu cầu kỹ thuật đối với một sản phẩm và các yêu cầu đặt ra trong quá trình giám sát sử dụng sản phẩm tại cơ sở y tế đều bị ảnh hưởng.
Có nhiều thay đổi xung quanh việc phân loại sản phẩm. Ngoài việc giới thiệu loại lr mới cho các dụng cụ phẫu thuật có thể tái sử dụng, các yêu cầu đối với sản phẩm cấy ghép loại IIb đã đặc biệt tăng lên. Hơn nữa, nhiều loại sản phẩm đã được phân loại rủi ro cao hơn. MDR tăng các yêu cầu liên quan đến bằng chứng lâm sàng của thiết bị y tế. Trong tương lai, tất cả các thiết bị y tế, bất kể loại rủi ro của chúng, sẽ yêu cầu đánh giá lâm sàng. Quy trình giám sát mới yêu cầu cải thiện giám sát trước khi đưa ra thị trường đối với các sản phẩm cấy ghép mới thuộc nhóm rủi ro III, cũng như các thiết bị y tế dùng để đưa thuốc vào cơ thể và/hoặc loại bỏ thuốc thuộc nhóm IIb. Hiện nay, ngoài các yêu cầu ngày càng tăng đối với chủ sở hữu thiết bị y tế, còn có các quy tắc nghiêm ngặt hơn được áp đặt lên các cơ quan thông báo. Để có thể phê duyệt thiết bị y tế, nhiều yêu cầu bổ sung khác nhau phải được đáp ứng. Ngoài ra, các cơ quan thông báo có nghĩa vụ thực hiện kiểm định không báo trước tại các chủ sở hữu thiết bị y tế. Các yêu cầu bổ sung đối với tài liệu kỹ thuật từ phía chủ sở hữu thiết bị y tế phải cung cấp làm tăng đáng kể khối lượng và độ phức tạp của tài liệu.
Không có mã định danh chính xác nào trên sản phẩm để cho biết có tuân thủ MDR. Tuy nhiên, ký hiệu ISO mới "MD" dành cho thiết bị y tế sẽ được đặt trên nhãn cùng với việc giới thiệu MDR.
Có, tất cả thiết bị y tế thuộc tất cả các nhóm rủi ro, bao gồm các đơn vị và hệ thống điều trị, đều bị ảnh hưởng.
Dữ liệu liên quan dành cho công chúng hiện nay đã có thể xem được ở cơ sở dữ liệu trung tâm của châu Âu. Phiên bản mở rộng của EUDAMED sẽ được áp dụng từng bước, tức là tự nguyện sử dụng phiên bản "sản phẩm khả thi tối thiểu" (MVP) vào năm 2022. Việc sử dụng bắt buộc của EUDAMED dự kiến diễn ra trong Quý 2 năm 2025. Xemthời gian thực thi EUDAMED
Các đơn vị hợp pháp bao gồm nhà sản xuất thiết bị y tế, nhà sản xuất các hệ thống và gói quy trình, nhà nhập khẩu hoặc đại diện được ủy quyền để phân phối thiết bị y tế tại EU phải bổ sung dữ liệu EUDAMED liên quan đến vai trò của người tham gia, cũng như dữ liệu liên quan đến sản phẩm cho mỗi sản phẩm riêng lẻ được phân phối tại EU.
Sau khi MDR được công bố vào ngày 5 tháng 5 năm 2017, quy định này có hiệu lực vào ngày 25 tháng 5 năm 2017, với giai đoạn chuyển tiếp dự kiến kéo dài đến ngày 26 tháng 5 năm 2020. Do đại dịch COVID-19, việc áp dụng bắt buộc của MDR đã bị hoãn đến tháng 5 năm 2021. Theo sửa đổi lần thứ 2 của MDR, thời gian chuyển đổi được kéo dài đến tối đa Tháng 12 năm 2028, nghĩa là các chứng nhận MDD sẽ duy trì tính hợp lệ của chúng nếu đáp ứng một số điều kiện tiên quyết nhất định (chỉ cho đến tối đa Tháng 12 năm 2027 đối với thiết bị phân loại rủi ro III và thiết bị cấy ghép phân loại IIb).
Thiết bị y tế không được gây ra bất kỳ rủi ro không thể chấp nhận nào đối với sức khỏe và tính an toàn.
QMS đã tuân thủ MDR.
Đơn đăng ký MDR được ký trước tháng 5 năm 2024.
Hợp đồng MDR với Cơ quan thông báo sẽ được ký trước tháng 9 năm 2024.
không có thay đổi đáng kể nào được áp dụng cho các sản phẩm MDD.
Theo sửa đổi lần thứ 2 của MDR, không còn thời hạn bán hết (sell-off) cuối cùng nữa. Giai đoạn bán hết (sell-off) theo kế hoạch trước đó (tức là không phân phối thêm sản phẩm được chứng nhận MDD sau tháng 5 năm 2025) đã bị hủy bỏ.
Chứng chỉ MDD EC được gia hạn tự động (không có chứng chỉ mới nào được cấp).
Giấy chứng nhận MDD và MDR EC sẽ có hiệu lực song song trong thời gian gia hạn.
Cả sản phẩm MDD và MDR đều có thể được đưa ra thị trường song song.
Do đại dịch COVID-19, đơn đăng ký bắt buộc đối với MDR đã được thiết lập vào ngày 26 tháng 5 năm 2021. Điều này dẫn đến thời hạn tiếp thị thiết bị y tế như sau tùy vào phân loại sản phẩm:
Loại I Ngày 26 tháng 5 năm 2021
Loại Ir, s, m, Loại IIa, Loại IIb và Loại III: ngày 26 tháng 5 năm 2024
Đánh giá tuân thủ cho biết liệu một sản phẩm và chủ sở hữu thiết bị y tế tương ứng có tuân thủ các yêu cầu của MDR Châu Âu hay không. Tùy thuộc vào phân loại rủi ro của từng sản phẩm, B. Braun có quyền tự thực hiện đánh giá này. Các đánh giá bổ sung được thực hiện thông "cơ quan thông báo".
Cơ quan thông báo là một công ty tư nhân được chỉ định thay mặt cho Liên minh Châu Âu để đánh giá sự tuân thủ của chủ sở hữu thiết bị y tế với MDR. Hiện tại, đánh giá được thực hiện bằng các cuộc kiểm tra và sau khi vượt qua các cuộc kiểm tra này, các cơ quan công nhận sẽ đánh giá các quy trình của chủ sở hữu thiết bị y tế về sự tuân thủ MDR. Ngay khi sự tuân thủ quy trình được xác minh, sản phẩm có thể được đăng ký thông qua các quy trình này.
Ngay cả sau khi chuyển đổi toàn bộ danh mục sản phẩm sang MDR, các chủ sở hữu thiết bị y tế sẽ phải đối mặt với chi phí tăng thêm đáng kể do các yêu cầu tăng lên của MDR.
Mục tiêu chính của quy định này là bảo vệ tốt hơn sức khỏe cộng đồng, an toàn hơn cho người bệnh, minh bạch hơn, an toàn pháp lý hơn và một khái niệm hướng tới châu Âu hơn. Điều này sẽ đạt được thông qua các yêu cầu mở rộng hơn về tài liệu kỹ thuật của sản phẩm trong một hệ thống quản lý chất lượng tuân thủ MDR.
Quy định (EU) 2023/607 quy định rằng các chứng chỉ được cấp theo MDD trước ngày 25 tháng 5 năm 2017 và còn hợp lệ tại thời điểm ngày 26 tháng 5 năm 2021 vẫn hiệu lực bất kể ngày hết hạn của chúng. Điều này có nghĩa là các sản phẩm có tuyên bố tuân thủ MDD hợp lệ cho đến ngày 26 tháng 5 năm 2021 có thể tiếp tục được đưa ra thị trường EU.
Các sản phẩm đã có trên thị trường trước ngày 26 tháng 5 năm 2021 và có tuyên bố tuân thủ MDD có thể tiếp tục được đưa ra thị trường miễn là tuyên bố tuân thủ MDD có hiệu lực. Thời hạn hiệu lực kéo dài cho đến tháng 5 năm 2027 (đối với các loại rủi ro cấy ghép III và IIb) và cho đến tháng 5 năm 2028 (đối với tất cả các loại rủi ro khác - ngoại trừ loại I).
Quy định (EU) 2023/607 đã bãi bỏ thời gian bán hết các sản phẩm MDD, được thiết lập ban đầu sẽ hết hạn vào ngày 27 tháng 5 năm 2025.
Chủ sở hữu thiết bị y tế xác nhận bằng tuyên bố riêng của chủ sở hữu thiết bị y tế (thư xác nhận) rằng thiết bị y tế của mình tuân thủ các yêu cầu pháp lý hiện hành. Theo Quy định (EU) 2023/607, tính hợp lệ của tất cả các chứng nhận chưa hết hạn vào ngày 20 tháng 3 năm 2023 được kéo dài đến ngày 31 tháng 12 năm 2027 (đối với các sản phẩm có thể cấy ghép thuộc loại III và IIb) hoặc đến ngày 31 tháng 12 năm 2028 (đối với tất cả các sản phẩm khác - ngoại trừ loại I). Nhà sản xuất phải đáp ứng các điều kiện sau đây để chứng nhận và tuyên bố tuân thủ tiếp tục có hiệu lực.
Là nhà sản xuất thiết bị y tế, B. Braun phải tuân thủ các yêu cầu của MDR. Các nhóm làm việc khác nhau đang cập nhật tài liệu kỹ thuật và sửa đổi quy trình để đảm bảo tuân thủ MDR. Ngoài ra, B. Braun có nghĩa vụ cung cấp thông tin sản phẩm, bao gồm dữ liệu nhận dạng thiết bị duy nhất (UDI), cũng như thông tin giám sát sau khi sản phẩm được đưa ra thị trường cho EUDAMED.
Tập đoàn B. Braun đã khởi xướng các biện pháp toàn diện và cung cấp các nguồn lực để đảm bảo việc thực hiện MDR đúng tiến độ.
Tất cả thiết bị y tế
Trong một thời gian, B. Braun đã nỗ lực chuẩn bị thực hiện các quy định mới để có thể triển khai đúng thời hạn.
Các hệ thống quản lý chất lượng của B. Braun Melsungen AG, B. Braun Avitum AG và Aesculap AG đã được chứng nhận theo MDR và các tài liệu kỹ thuật tuân thủ MDR cho các sản phẩm đã được chuẩn bị. Việc chuyển sản phẩm sang MDR sẽ diễn ra liên tục cho đến thời hạn tối đa.
Nói chung, tùy thuộc vào vòng đời của sản phẩm đã lên kế hoạch, các sản phẩm sẽ được chứng nhận theo MDR. Như những năm trước, B. Braun sẽ tiếp tục điều chỉnh danh mục sản phẩm của mình. Các sản phẩm mới sẽ được thêm vào danh mục sản phẩm và các thế hệ cũ sẽ được thay thế, hoặc các sản phẩm không kinh tế hoặc đã lỗi thời sẽ bị loại bỏ khỏi danh mục sản phẩm. Là một phần trong quy trình quản lý phân loại thường xuyên của công ty, chúng tôi sẽ tiếp tục truyền đạt những thay đổi tương ứng về phân loại sản phẩm một cách kịp thời, cởi mở, minh bạch cho các đối tượng mục tiêu tương ứng bị ảnh hưởng và cung cấp các lựa chọn thay thế nếu có thể.
B. Braun đang trong giai đoạn thực hiện chuyển đổi danh mục sản phẩm của mình theo yêu cầu chứng nhận MDR. Trong giai đoạn chuyển đổi này, B. Braun đưa cả các sản phẩm được chứng nhận MDD và MDR ra thị trường.
TÜV Süd đã được công nhận là cơ quan chứng nhận thứ hai trên toàn thế giới vào tháng 5 năm 2019. Các cơ quan chứng nhận khác giám sát các thiết bị y tế của B. Braun là MedCert, Dekra và TÜV Rheinland cũng đã được chỉ định theo MDR. Vui lòng kiểm tra liên kết đến trang web của Ủy ban Châu Âu để có được tổng quan về các cơ quan thông báo sự tuân thủ MDR.
Trang web của Ủy ban Châu Âu
a) Việc nhận dạng thiết bị y tế sẽ thay đổi khi có mã định danh nhận dạng thiết bị duy nhất (UDI).
b) Có thể phát sinh các yêu cầu tài liệu bổ sung khi thông qua các sản phẩm Loại III mới.
c) Cơ sở dữ liệu EUDAMED cung cấp cho khách hàng sự minh bạch hơn về sản phẩm.
B. Braun đã sẵn sàng cho MDR và đã đầu tư rất nhiều để đạt được điều này. Vấn đề chi phí chủ yếu là do các yêu cầu toàn diện hơn về tài liệu kỹ thuật, giải pháp kỹ thuật và hệ thống để đáp ứng yêu cầu quản lý dữ liệu EUDAMED cũng như tăng nỗ lực giám sát sau khi sản phẩm ra thị trường.
B. Braun đang tích cực hỗ trợ khách hàng trong việc thu thập thông tin. Vì lý do này, Tuyên bố tuân thủ và Thông tin sử dụng (IFU) được liên tục xây dựng dưới dạng thông tin điện tử kể từ tháng 5 năm 2021.
Có thể tìm thấy các công bố trực tuyến tại www.bbraun.com - chỉ cần nhập tên sản phẩm vào trường tìm kiếm và tìm các công bố tương ứng trong tiêu đề -tài liệu liên quan-. Hầu hết các công bố của B. Braun Melsungen AG và B. Braun Avitum AG có thể được truy cập thông qua kênh này. Vì lý do kỹ thuật, B. Braun sẽ chỉ có thể cung cấp các công bố cho sản phẩm của Aesculap AG (trừ danh mục vật liệu chỉ) trực tuyến trong trung hạn. Nếu ngẫu nhiên tìm các công bố nhưng không thấy trực tuyến, bạn có thể liên hệ với bộ phận dịch vụ khách hàng của các công ty con của B. Braun tại các nước.
Có thể tải về hướng dẫn sử dụng tại https://eifu.bbraun.com Sau khi nhập mã sản phẩm hoặc GTIN, các tài liệu liên quan đến sản phẩm sẽ được hiển thị.
Hầu hết các văn bản xác nhận đều có sẵn trực tuyến tại bbraun.com trong tài liệu sản phẩm tương ứng. Nếu không thể tìm thấy các tài liệu trực tuyến, bạn có thể gửi yêu cầu từ đơn vị bán hàng tương ứng. Có thể tìm thấy thông tin tổng quan về tổ chức tại các nước ở đây.
Thư xác nhận từ Cơ quan thông báo đề cập đến Quy định (EU) 2023/607 và cũng là thư xác nhận. Trong thư này, Cơ quan thông báo xác nhận rằng chủ sở hữu thiết bị y tế (bao gồm các thiết bị liên quan) tuân thủ các yêu cầu của Quy định này. Các thư xác nhận này có thể được cung cấp thông qua bộ phận dịch vụ khách hàng.
MDR chỉ quy định rằng cần phải cung cấp chỉ dẫn rõ ràng về thời hạn sử dụng hoặc cấy ghép thiết bị một cách an toàn, được thể hiện ít nhất theo năm và tháng, nếu phù hợp.
Có thể sử dụng các sản phẩm của B. Braun có ngày hết hạn kèm theo tháng và năm cho đến cuối tháng.
Dưới đây là các liên kết hữu ích về thông tin trên trang web chính thức của Ủy ban Châu Âu và các nguồn khác.
Bảng thông tin dành cho các chuyên gia y tế (trang web của EU)
link
Tạp chí EU: Quy định đối với Thiết bị Y tế
link
Danh sách các cơ quan được thông báo (EU)
link
Khung thời gian EUDAMED (EU)
link
Hướng dẫn sử dụng điện tử của B.Braun (eIFU)
link
Bảng dữ liệu về MDR của B. Braun
pdf, 53.7 KB
Hỏi đáp về các khía cạnh thực tế đối với các quy định chuyển tiếp của MDR
link